DE ACORDO COM A PROPORÇÃO DO SOLUTO EM RELAÇÃO AO SOLVENTE
Num determinado dia, ao receber visitas em sua casa, você resolve preparar suco de laranja e suco de uva para servir a seus convidados. Ao servir o suco de laranja, nota-se que algumas pessoas fazem cara feia e dizem: nossa como está forte! Enquanto que outras pessoas que beberam suco de uva dizem: Hum, este está muito fraco!
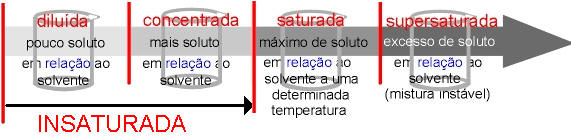
Nestes dois casos descritos acima, podemos observar que temos dois tipos de soluções: diluída e concentrada.
DILUÍDA
Pouco soluto dissolvido em relação ao solvente (suco de uva).
CONCENTRADA
Muito soluto dissolvido em relação ao solvente (suco de laranja).
Ao juntarmos, gradativamente, açúcar e água em temperatura constante e sob agitação contínua, notamos que o sólido se dissolve, até não poder ser mais visto. Vamos acrescentando mais açúcar e tornando a solução mais concentrada, até que em um dado momento, o açúcar não se dissolve mais na água, mas se deposita no fundo ou se precipita ou se deposita ou se decanta. Neste momento, dizemos que a solução está saturada e apresenta um corpo de fundo.
SATURADA
Solução que contém uma quantidade máxima de soluto dissolvido no solvente numa determinada temperatura e pressão.
Esta quantidade máxima de soluto dissolvido é expresso através do coeficiente de solubilidade (CS).
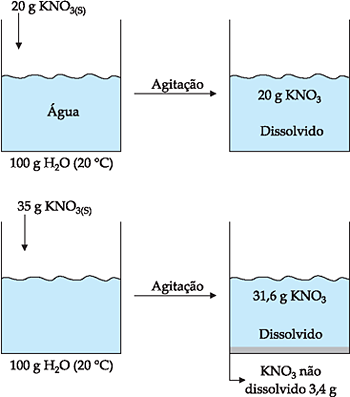
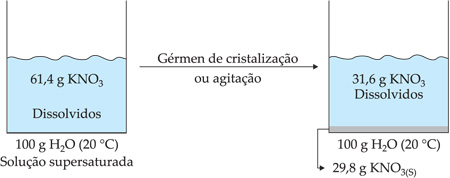
Por exemplo, a 20 °C, a solubilidade do KNO3 é 31,6 g em cada 100 g de H2O. Isto significa que podemos dissolver até 31,6 g de KNO3 a 20 °C em 100 g de H2O.
A variação de temperatura pode alterar o coeficiente de solubilidade de uma substância. Geralmente, o aumento da temperatura aumenta a solubilidade da maioria das substâncias.
INSATURADA OU NÃO SATURADA
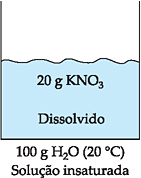
Ocorre quando a quantidade de soluto adicionada é inferior ao coeficiente de solubilidade. Por exemplo, o coeficiente de solubilidade do KNO3 em água a 20 °C é 31,6 g/100 g H2O, portanto, a adição de qualquer quantidade de KNO3 abaixo de 31,6 g em 100 g de água, a 20 °C, produz solução insaturada
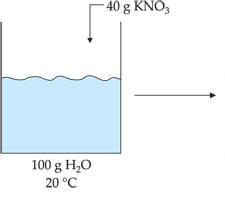
SUPERSATURADA
Solução que contém uma quantidade de soluto dissolvido superior à solução saturada por meio de uma variação de temperatura.
Por exemplo: a 40 °C, a solubilidade do KNO3 é 61,47 g/100 g H2O e, a 20 °C, é 31,6 g/100 g H2O.
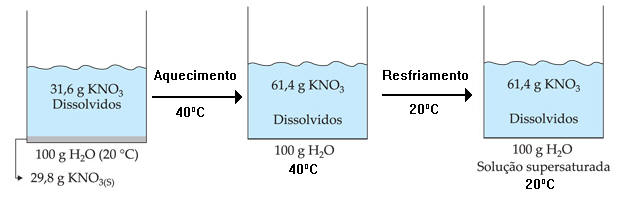
As soluções supersaturadas são instáveis, ou seja, qualquer perturbação no meio irá fazer com que o KNO3 precipite, tornando o sistema heterogêneo.
Resumindo temos:


Nenhum comentário:
Postar um comentário