Definição (Arrhenius)
Ácidos são compostos que, em solução aquosa, liberam, exclusivamente como cátion, o íon hidrônio.Os hidrogênios contidos na molécula da substancia que, em solução, fornecem o H3O+, são chamados hidrogênios ionizáveis. Nos ácidos oxigenados o hidrogênio ionizável está ligado a oxigênio.

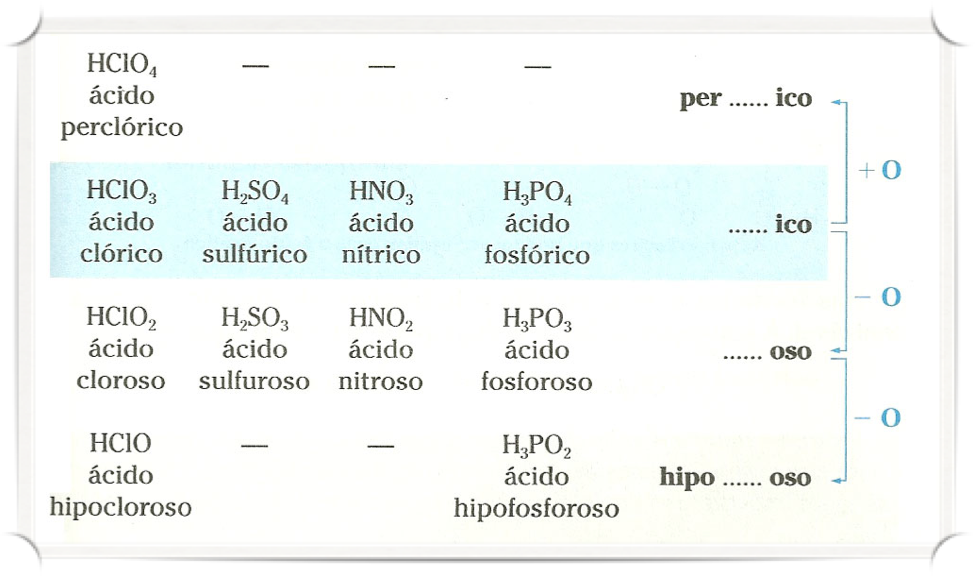
Nomenclatura

Hidrácidos (ácidos não-oxigenados)
Coloca-se a palavra ÁCIDO seguida do nome do elemento (ou radical) ligado hidrogênio, com terminação ÍDRICO.Ácido _______ídrico.
Exemplo:
HF Ácido Fluorídrico; HCl Ácido Clorídrico; HBr Ácido Bromídrico;
HI Ácido Iodídrico; H2S Ácido Sulfídrico; HCN Ácido Cianídrico.
Oxoácidos (ácidos oxigenados)
Ácido _______ico.
Exemplo:
H3BO3 – Ácido Bórico; H2CO3 – Ácido Carbônico; HNO3 – Ácido Nítrico;
H3PO4 – Ácido Fosfórico; H2SO4 – Ácido Sulfúrico; HClO3 – Ácido Clórico.
Ácido _______oso.
Exemplo:
HNO2 – Ácido Nitroso; H3PO3 – Ácido Fosforoso; H2SO3 – Ácido Sulfuroso; HClO2 – Ácido Cloroso.
Ácido Hipo_______oso.
Exemplo:
H3PO2 – Ácido Hipofosforoso; HClO – Ácido Hipocloroso.
Ácido Per_______ico.
Exemplo:
HClO4 – Ácido Perclórico.
Exemplo:
H3PO4 – Ácido Fosfórico ou Ácido Ortofosfórico;
Os ácidos resultantes de desidratações recebem o prefixo META ou PIRO, segundo as regras:

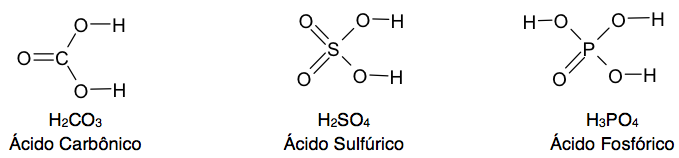
Fórmulas estruturais dos ácidos oxigenados
A regra para determinação das fórmulas estruturais consiste na seguinte sequência:- Escrever o símbolo do elemento que está no centro da fórmula molecular;
- Colocar um oxigênio entre cada hidrogênio e o elemento central;
- Ligar os oxigênios restantes, se houver, ao elemento central.
Ionização de ácidos
Ácidos são substâncias moleculares que, ao se dissolverem em água, sofrem ionização originando H+ como único íon positivo. O íon negativo que restar possuirá tantas cargas negativas quanto forem os H+ liberados.[1]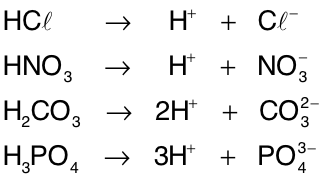
Os ácidos podem ser classificados de acordo com o número de hidrogênios ionizáveis que há em suas moléculas. Assim, HCl e HNO3 são monoácidos, H2CO3 e H2SO4 são diácidos, H3PO4 e H3BO3 sãotriácidos e H4P2O7 é tetrácido.
Ionização em etapas
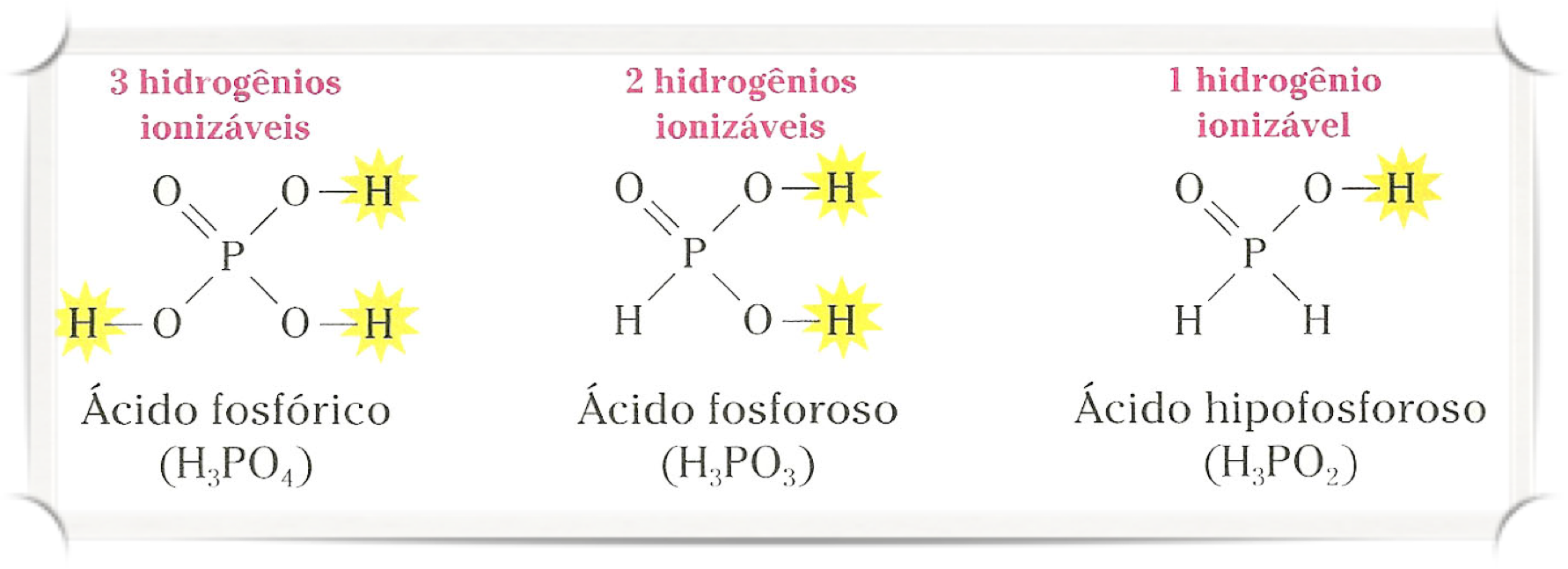
Quando um ácido libera mais de um H+, na verdade ele o faz em etapas, liberando um por vez. Por exemplo:
O ácido fosforoso apresenta dois hidrogênios ionizáveis (diácidos), e o ácido hipofosforoso apenas um (monoácido).

Nenhum comentário:
Postar um comentário