Definição
Sal é todo composto que, em solução, libera pelo menos um cátion diferente de H3O+ e pelo menos um ânion diferente de OH–. Exemplos: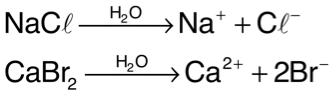
Neutralização ácido-base
A neutralização faz com que os íons H+ e OH– presentes em solução se transformem em água e, dessa forma, apenas os outros íons provenientes do ácido e da base permaneçam em solução. ácido + base → sal + água Exemplo: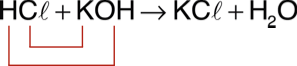
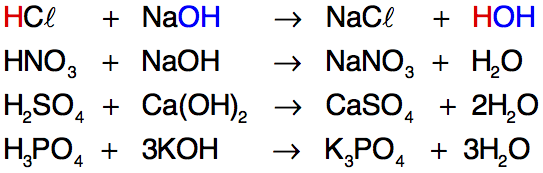
Quando a quantidade de íons H+ fornecidos pelo ácido for igual à de íons OH– fornecidos pela base, acontecerá neutralização total. A neutralização parcial ocorre quando há um excesso de H+ (neutralização parcial do ácido) ou de OH– (neutralização parcial da base). Assim, resta na fórmula do sal H+ ou OH– sem sofrer reação. Exemplos:
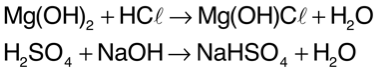
Nomenclatura
Coloca-se o nome do ânion (derivado do ácido por troca de determinação) e o nome do cátion (derivado da base). ___nome do ânion___ de ___nome do cátion___| Terminação do ácido | Terminação do sal |
|---|---|
| ídrico | eto |
| ico | ato |
| oso | ito |

NaCl – Cloreto de Sódio;
KNO2 – Nitrato de Potássio;
NH4NO3 – Nitrato de Amônio;
NaNO2 – Nitrito de Sódio ;
FeCℓ2 – Cloreto de Ferro (II) ou Cloreto Ferroso;
Fe(NO3)3 – Nitrato de Ferro (III) ou Nitrato Férrico;
Fe2S3 – Sulfeto de Ferro (III) ou Sulfeto Férrico;
CuSO4 – Sulfato de Cobre (II) ou Sulfato Cúprico;
Mg3(PO4)2 – Fosfato de Magnésio.
A única diferença dos sais normais é que indicaremos a quantidade de hidrogênios ionizáveis por meio dos prefixos mono-hidrogeno (o mono pode ser omitido), di-hidrogeno etc.
NaH2PO4 – di-hidrogeno-fosfato de sódio
Na2HPO4 – (mono-)hidrogeno-fosfato de sódio
NaHSO4 – (mono-)hidrogeno-sulfato de sódio
NaHCO3 – (mono-)hidrogeno-carbonato de sódio
Os hidrogenos-sais eram antigamente chamados de sais ácidos. Assim, outra opção para dar nome a esses sais é utilizar-se dos termos monoácido, diácido etc.
NaH2PO4 – fosfato diácido de sódio
NaHSO4 – sulfato (mono)ácido de sódio
Quando o hidrogeno-sal for originário de um ácido com dois hidrogênios ionizáveis (e somente nesses casos), pode-se substituir o prefixo mono-hidrogeno por bi. Nesse contexto, o prefixo Bi não tem o significado de “dois”.
NaHSO4 – bisulfato de sódio
NaHCO3 – bicarbonato de sódio
Nomenclatura semelhante a dos hidrogenia-sais.
Al(OH)2Cl – di-hidroxi-cloreto de alumínio
Al(OH)Cl2 – (mono-)hidróxi-cloreto de alumínio
Ca(OH)NO3 – (mono-)hidroxi-nitrato de cálcio
Ou ainda, de acordo com uma nomenclatura antiga
Al(OH)2Cl – cloreto dibásico de alumínio
Al(OH)Cl2 – cloreto (mono)básico de alumínio
Ca(OH)NO3 – nitrato (mono)básico de cálcio

Nenhum comentário:
Postar um comentário